BIBS – Bioressources : Imagerie, Biochimie & Structure
Description
La plate-forme accompagne depuis 20 ans les chercheurs académiques et privés dans l’exploration des bioressources et des bioproduits, de la molécule à l’objet, pour l’alimentation, la santé et la bioéconomie. BIBS conduit des développements méthodologiques innovants et apporte une expertise analytique qui concerne l’observation des macrostructures, la caractérisation des biopolymères (identification, modifications), leurs interactions, leur organisation et leur localisation dans des systèmes d’origine biologique (tissus ou organes végétaux, algues, milieux bactériens…) ou synthétique (aliments, matrices alimentaires, biofilms, matériaux composites…). Les outils disponibles permettent également d’aborder des paramètres dynamiques (diffusion, mobilité de l’eau), de suivi d’activités de dégradation ou de transformation, ainsi que de cribler des collections larges d’échantillons sur des critères chimiques et structuraux. BIBS a également pour mission de réaliser des développements méthodologiques innovants. Nous avons des équipements scientifiques au plus haut niveau en spectrométrie de masse, microscopie, RMN et criblage chimique. BIBS bénéficie de l’appui d’un groupe de bioinformatique dédié pour le traitement des données (spectres et images). La plate-forme BIBS fait partie du GIS Biogenouest, est certifiée ISO9001, labellisée IBISA, INRAE et intégrée dans 3 infrastructures nationales (Phenome-Emphasis, PROBE et CALIS).
Localisation
PF BIBS, UR 1268 BIA, INRAE Nantes
Contacts
Responsable plateforme : Sophie LE GALL
Site Internet : https://www.bibs.inrae.fr/
Coordonnateur du projet ciblé associé : Jean-François GERARD
Caractéristiques techniques
Analyses structurales
- Trappe Ionique Amazon SL (Bruker) (2018) (Technologie ESI-IT – couplé avec une UPLC) modifiée pour une activation des ions par des cations d’hélium accélérés (fragmentation MS/MS à haute énergie par CTD, Charge Transfer Dissociation) pour la caractérisation structurale des oligosaccharides
- Select SERIES Cyclic IMS (Waters) (2019) (Technologie ESI-Q-IM-TOF – couplé avec une UPLC).Un appareil équipé d’une cellule de mobilité ionique haute résolution (mobilité ionique cyclique), pour la séparation d’isomères structuraux de carbohydrates et leur détermination structurale par MS/MS
- Q-Exactive HF (Thermo-Fisher) (2019) (Technologie ESI-Q-Orbitrap – couplé avec une nano-UPLC) pour la protéomique et la peptidomique
- Spectromètre RMN haut champ Avance III 9.4T WB (Bruker) (2018) Equipé de sondes CPMAS et HRMAS, statiques X et HX pour l’étude des échantillons solides à mous
- Deux spectromètres RMN bas champ Minispec Mq20 0.47T (2009 et 2018) (Bruker) pour les mesures de densité et mobilité de l’eau et de petits solutés.
- Extracteurs ASE 350 (Thermo-Fisher, deux extracteurs 2010 et 2012) et plateforme de préparation automatisée (Swing SL robotic workflow station, Chemspeed, 2011) pour l’extraction automatisée et préparation (dérivation, hydrolyse) des polysaccharides, à moyen débit.
- TRACE GC Ultra et TRACE ISQ (Thermo-Fisher, 2011) pour l’analyse compositionnelle en monosaccharides, détermination des liaisons.
- HPAEC, ICS 6000 (Thermo-Fisher) (2019) et ACQUITY ELSD FLUO SQD2 (Waters) (2016 et 2020) pour l’analyse structurale des mono/oligosaccharides et leur quantification.

Modalités d’imagerie
- Modalités d’imagerieMALDI TOF rapifleX Tissue typer (Bruker) (2018) pour l’imagerie moléculaire à haute cadence de tir (10 kHz) et une résolution spatiale de l’ordre de 5-µm.
- Microscope à force atomique (Bruker) couplé en Raman (Renishaw) (2013) pour l’observation des structures et de la topographie à l’échelle nanométrique et les mesures de module élastique & composition chimique localisée.
- Microscope électronique à transmission 1230 (JEOL)(2005). Fonctionnement en mode cryogénique et conventionnel pour l’observation des structures à l’échelle nanométrique.
- Microscope électronique à balayage Quattro S (Thermo-Fisher) (2019). Fonctionnement en mode environnemental, adapté aux échantillons mous et hydratés, mode transmission (STEM), analyseur élémentaire, pour l’observation des structures à l’échelle mésoscopique.
- Microscope confocal à balayage laser A1R (NIKON) (2009, jouvence partielle en 2019). Microscopie de fluorescence pour l’observation à l’échelle micrométrique pour l’observation de molécules cibles (ex. protéines) après marquage.
- Spectromètre RMN haut champ Avance III 9.4T WB (Bruker) pour la micro-imagerie
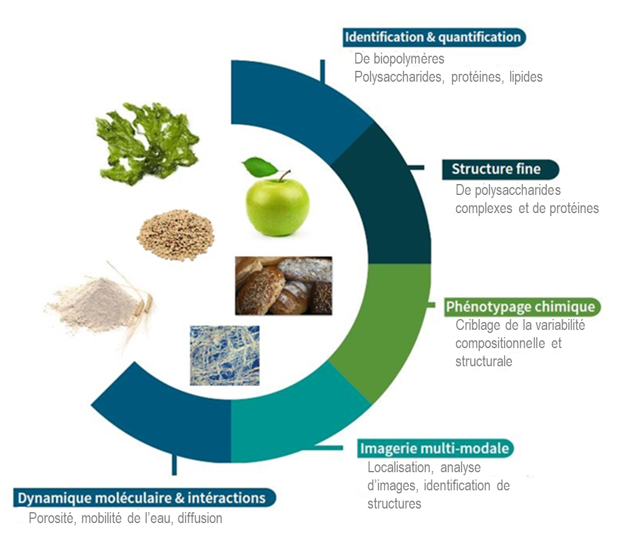
Projet ciblé associé